A melanin koncentráló hormonmorfológiai meghatározása humán, rágcsáló és madár agyban
megjelent:
A táplálékfelvétel központi idegrendszeri szabályozása humorális faktorok és idegi impulzusok által történik. A humorális rendszer meghatározó eleme a melanin koncentráló hormon (MCH). A MCH receptorok (MCHR) két típusa ismert, az MCHR1 nagyfokú homológiát mutat gerincesekben, míg az MCHR2 funkcionális formáját számos emlősállat nem expresszálja.
A táplálékfelvétel és energiaháztartás szabályozása komplex folyamat, amelyben a perifériáról (pl. emésztőrendszer, zsírszövet felől) érkező humorális (testfolyadékok elsősorban a vér által közvetített) faktorok, valamint autonóm idegrendszeri impulzusok az agy meghatározott területein integrálódnak. Ezen információkat a hypothalamus és agytörzsi központok feldolgozzák és döntenek fokozni vagy éppen csökkenteni kell a táplálékbevitel mértékét. Ugyanakkor a rendszer komplexitását jellemzi, hogy „magasabb rendű” neocorticális, subcorticális és limbikus szabályozás is megvalósul (1. ábra), ezzel magyarázható, hogy hangulatunk képes befolyásolni éhségérzetünket.
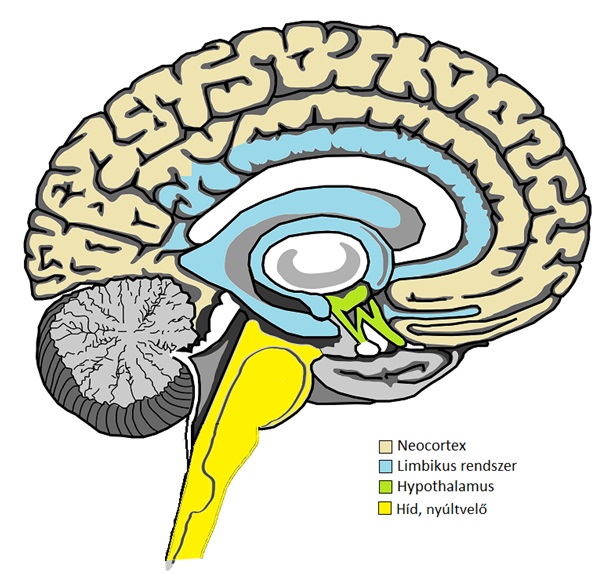
1. ábra: A táplálékfelvétel központi idegrendszeri szabályozásában résztvevő területek (Humán agyfélteke középvonali nézet; A jelöletlen sematikus ábra forrása: commons.wikimedia.org)
Melanin koncentráló hormon (MCH) és receptorai
Az MCH egy 19 aminosavból álló fehérje, amit Kawauchi és mtsai. izoláltak és karakterizáltak elsőként lazac agyalapi mirigyből, ahol a melanocyták melanin aggregációjának fokozásával szabályozza a halak bőrszínét. Később számos emlősállat agyában kimutatták jelenlétét, itt azonban a bőr pigmentációjának meghatározásában nincs bizonyított szerepe. Számos, elsősorban rágcsálókon végzett, tanulmány igazolta az MCH szerepét a táplálékelvétel és energia homeosztázis, emócionális állapot, stressz-válasz és alvás-ébrenlét ciklus szabályozásában. Patkányok agyában a hormont kifejező idegsejtek, legnagyobb mennyiségben a lateralis hypothalamus és a zona incerta területén találhatóak. A hypothalamus lateralis magcsoportja az elsődleges orexigén (táplálék felvételt indukáló) központ, ami széleskörű projekciót az ad idegrendszer számos területére. Az agytörzsi afferentáció útján, a X. agyideg közvetítésével befolyásolja az emésztőrendszer működését5, továbbá kis mennyiségben a gyomor-bélrendszeren belül is detektálható MCH, ami alátámasztja az emésztésben betöltött szerepét, ugyanakkor kimutatható jelenléte a hereszövetben is, feltételezve hogy a reproduktív folyamatok szabályozásában is részt vesz6.
Ahhoz, hogy az hormon funkcióját el tudja látni szükség van olyan speciális a sejtmembránban elhelyezkedő struktúrákra úgynevezett receptorokra, amik a ligand megkötése esetén intracelluláris változások láncolatát indítják be. Az MCH első receptorát (MCHR1) 1999-ben azonosították 2001-ben karakterizálták a második receptort (MCHR2), ami meglepő módon csupán 38 százalékos azonosságot mutatot a MCHR1-el. A fajok közötti megoszlásban is jelentős eltérések tapasztalhatók, míg MCHR1 az emlősök nagy részében kifejeződik, addig az MCHR2 funkcionális formája számos élőlényből hiányzik (pl. egér patkány).
Kísérletes adatok bizonyítják az MCH és receptorának esszenciális szerepét a táplálékfelvétel szabályozásában. Éhezés hatására az MCH mRNS szintje emelkedik rágcsálókban, ezzel összhangban az oldalkamrába közvetlenül adott hormon infúzió evést indukál. Transzgenikus egerekben lehetőség van egyes géneket „kiütni,” annak érdekében ,hogy vizsgálni tudjuk milyen funkcionális következményekkel jár ez a módosítás, ami felhasználható egyes öröklődő betegségek tanulmányozására. Az MCH túlzott mértékű kifejeződése elhízást eredményez. Azok a transzgenikus úgynevezett „knoc-out(KO)” egerek, amelyekben MCH hiányzott hipofágiásak (csökkent táplálékfelvétel) és soványak voltak. Az MCHR1-KO egerek testtömege a normál tartományon belül mozgott, ugyanakkor soványnak imponáltak és a teljes testzsír mennyiségé csökkent.,habár a receptor hiányában hiperfágia (fokozott táplálékfelvétel) alakult ki, a társuló hiperaktivitás és fokozott metabolizmus következtében ez nem járt elhízással.
Neuropatológia vizsgálatok
Az MCH nemcsak a táplálékfelvétel szabályozásában, hanem a limbikus rendszerbe adott projekciói révén a különböző hangulati zavarok (pl. szorongás, depresszió) befolyásolásában is esszenciális szerepet tölt be. Az MCHR1 receptort gátolni képes (antagonista) molekulák fejlesztése ígéretes terápiás módszerek lehetnek a világszerte hatalmas problémát jelentő elhízás és depresszió kezelésében, ugyanakkor, az agrárágazatban a rendszer aktivitásának fokozása, ezzel együtt a gazdasági állatok testtömegének növelése a kívánatos cél. Ha sikerül olyan alapanyagokat azonosítanunk amiket a táphoz keverve az állatok saját (endogén) MCH hormon szintjét képesek megemelni, az teoretikusan magasabb hozamot eredményezhet és kiválthatja a jelenleg alkalmazott gazdaságilag és/vagy etikailag megkérdőjelezhető módszereket.
Annak érdekében, hogy a különböző hatóanyagok MCH rendszerre kifejtette hatását tanulmányozni tudjuk és meggyőződjünk annak biztonságosságáról, elengedhetetlenek a morfológia vizsgálatok, amivel azonosítjuk a hormon és receptorának lokalizációját, szemi-kvantitatív képet kaphatunk az expresszió mértékéről és nyomon követhetjük a változásokat az adott táppal nem etetett, kontrol állatokhoz képest. Tudományos szempontból egyetlen vizsgálati eljárás nem elegendő, azt meg kell erősíteni több különböző patológiai technikán alapuló módszerrel
Kutatócsoportunk a projekt keretén belül a korábbi tapasztalatok alapján 14–16 három módszert (1. Kromogénes immunhisztokémia (IHC); 2. Receptor autoradiográfia; 3. Immunfluoreszcens immunhisztokémia (IF)) standardizált az MCH és MCHR1 morfológiai azonosítására, amely felhasználható humán, patkány és baromfi minták vizsgálatára.
A minták előkészítése során formalinos fixálást és parafinba ágyazást, valamint folyékony nitrogénben (-195 °C) fagyasztást egyaránt alkalmaztunk. Előző esetben 7 µm-es még utóbbi esetben 20 µm-es metszetek készültek.
1. Immunhisztokémia
A módszer alapja a mintában keresett antigén elleni immunreakcióval. Az elsődleges antitest megjelöli az antigént, majd egy erre az antitestre spiecifikus biotinált másodlagos antitestet alkalmazunk. A biotint megköti az avidint és a reakciónak megfelelő enzimet tartalmazó polimer. A színtelen szubsztrátot az enzim hasítja, ami színes csapadékot ad – a többlépéses reakció lényege a jelerősítés.
A kereskedelemben kapható antitestek közül kiválasztottuk az általunk vizsgált fajokra legspecifikusabbat. Bioinformatikai analízis során az NCBI (National Center for Biotechnology Information) adatbázisból letöltött hat élőlény (ember, nyúl, patkány egér, kacsa, liba) szekvenciáinak összehasonlítása megerősítette, hogy az MCH jelölésére alkalmazott immunhisztokémiai antitest által felismert fehérjeszekvencia nagymértékben konzervatív a vizsgált élőlényekben (3. ábra). Ezen eredmények alapján az emlős mintákon kívül az antitest jól használható a vizsgálni kívánt szárnyas állatokban is. A szekvencia illesztések mellett az MCH fehérje alapján elkészítettük az előlények törzsfáját is. A várakozásoknak megfelelően, az emlősök MCH aminosavsorrendje nagyobb mértékű eltérést mutat a madarakban expresszálódó fehérjéhez képest.

3. ábra: A melanin koncentráló hormon (MCH) fehérje aminosav-szekvenciájának fajok közötti összehasonlítása. Sárgával emeltük ki az MCH fehérje azon szakaszát, melyet a kiválasztott antitest felismer. Az ábrán csak azoknak az aminosavaknak a kódját tüntettük fel, amelyek eltérést mutattak a vizsgált élőlényekben. A ponttal jelölt aminosavak identikusak mind a hat fajban.
A mintákon való tájékozódás érdekében a patkány hypothalamust Paxinos-féle anatómiai atlasz segítségével hematoxylin festett metszeteken lokalizáltuk (5. ábra).
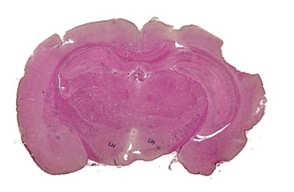
5. ábra. Patkány lateralis hypothalamus (LH) elhelyezkedése, coronális síkú metszeten. Festés hematoxylin
A kiválasztott MCH és MCHR1 antitestekkel külön végeztük egyszeres jelölést, valamint a kolokalizáció meghatározása érdekében kettős jelölést is. Utóbbi esetben a két antigén vizualizálásra eltérő színű szubsztrátot használtunk. Az általunk kidolgozott protokoll megbízhatóságát igazolja hogyMCH (6. ábra) és MCHR1 (7. ábra) antitest tekintetében erős immunpozitivitás tapasztalható patkány hypothalamusban. A kettős jelölés, más kutatócsoportok adatait alátámasztva, a hormon és receptorának nagy fokú megoszlásbeli átfedését mutatta (7.D.ábra). Hasonló eredményeket adott a libából származó minták vizsgálata. A szakirodalommal összhangban humán mintákon erős pozitivitás tapasztalható hypothalamus, a hídés a nyúltvelő régióiban20.
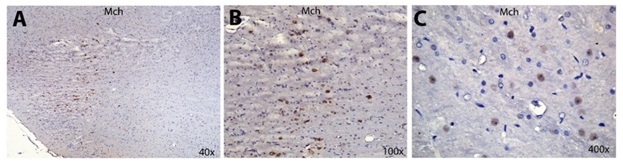
6. ábra: Formalin fixált paraffinba ágyazott patkány agyból származó minták anti-MCHantitesttel jelölve barna csapadékot adó 3,3'-diaminobenzidine (DAB) reakcióval vizualizálva; kék hematoxylin magfestés. Kis nagyítással (A panel - 40x) erőteljes immunpozitivitás jelenik meg a hypothalamus területén. Nagyobb nagyítással (B panel - 100x és C panel – 400x) megfigyelhető, hogy a reakció a citoplazmára lokalizálódik.



