Citokinvihar a COVID-19-fertőzésben
megjelent:
A COVID-19 betegség lefolyásáról és az egyes gyógyszerek alkalmazhatóságáról Szekanecz Zoltán (Debreceni Egyetem) és Constantin Tamás (Semmelweis Egyetem) készített összefoglalót.
A SARS-CoV-2 nagyon hasonló azon egyláncú RNS-t tartalmazó vírusokhoz, amelyek korábban a SARS, illetve a közel-keleti vírusfertőzést (MERS) okozták. A vírus a megfertőzendő sejtek, elsősorban a tüdő léghólyagocskáit borító, II. típusú hámsejteken kifejeződő angiotenzin-konvertáz enzim 2 (ACE2) receptorhoz kötődve jut a sejtbe. Az ACE2 nemcsak e sejteken, hanem a szívizom, vese, nyelőcső, gyomor, bél hámsejtjei, az ereket bélelő sejtsor, valamint bizonyos fehérvérsejtek felszínén is megjelenik.
A fertőzést követően a legtöbb beteg tünetmentes marad, vagy enyhe tünetek lépnek fel nála. A fertőzöttek 10-20%-ánál azonban, döntően időseknél és társbetegségekben is szenvedőknél súlyos állapot, gyorsan kifejlődő légzési elégtelenség vagy bakteriális felülfertőződés következtében szeptikus sokk alakul ki, amely magas halálozással jár. Mindez általános gyulladással jár együtt, amit a gyulladásos fehérjék fokozott termelése, az úgynevezett citokinvihar kísér.
Hogyan zajlik le a citokinvihar?
A SARS-CoV-2 által fertőzött sejt citoplazmájában kiszabadul a vírusból az RNS-genom, ami teret enged a vírus replikációjának. A sejtből aktív transzport révén kikerülő virális antigénpeptideket antigén-prezentáló sejtek (APC) prezentálják a T-limfocitáknak. Mindez aktiválja a sejtes és humorális immunválaszokat is. E folyamatok során a citotoxikus T-sejtek (TC) nagy mennyiségű citokint termelnek. A segítő (helper) T-sejtek (TH) aktiválják a B-sejteket és a humorális immunitást, az antitestek termelődését.
A vírus az említett szervek mellett az immunsejteket is megfertőzheti, aminek a klinikai jelentőséggel bíró alacsony fehérvérsejtszám (leukopénia, limfopénia) a következménye.
A citokinhálózat zavara alapvető szerepet játszik a klinikai tünetek kialakulásában és a súlyos kimenetelben.
Elsődleges az antivirális hatású I. típusú interferonok (IFN-α/β) jelentősen csökkent termelése, amely a vírus elleni védekezés defektusához vezet. Emellett a COVID-19-ben nagy mennyiségben termelődnek gyulladásos citokinek, elsősorban tumornekrózis-faktor-α (TNF-α), interleukinek (pl. IL-1β, IL-2, IL-6, IL-7, IL-10, IL-12, IL-18, IL-33), valamint kemokinek. A kemokinek a T-sejteket a vérből a gyulladásos szövet felé vonzzák, aminek következtében a vérben T-sejt-hiány, a szövetekben pedig, főleg a tüdőkben, gyulladás alakul ki.
A citokinek közül a kiemelkedő szerepet játszó IL-6 példáját bemutatva, a vér IL-6-szintje arányos a fertőzés súlyosságával és a limfopéniával. A súlyos COVID-19-betegek háromnegyedében, az enyhe esetek mindössze egyharmadában észleltek emelkedett IL-6-plazmaszintet. Az IL-6 mellett az IL-1 és TNF-α vérszintje is emelkedett. A gyógyulási fázisban a betegek IL-6- és TNF-α-vérszintje csökkent, és ez együtt járt a T-sejtek számának normalizálódásával. Ennek a három citokinnek a később tárgyalandó terápia szempontjából van jelentősége.
Lásd még Hogyan veszi át az irányítást a szervezet felett észrevétlenül a koronavírus?
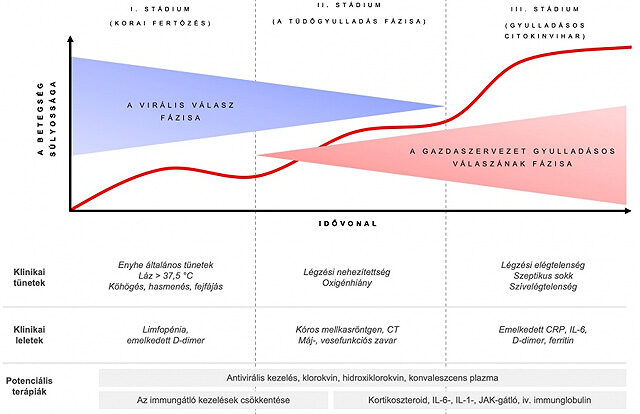
Ami a citokinvihar klinikai jelentőségét illeti, a COVID-19 időbeli lefolyását három stádiumra osztják. A lefolyás első felében a virális szakasz, a második felében a gazdaszervezet gyulladásos válasza dominál.
- Az I. szakasz a fertőzés korai időszaka változó légúti vagy gyomor-bél rendszeri tünetekkel, lázzal.
- A II. szakasz a tüdőfázis, amikor tüdőgyulladás alakul ki. Ebben a fázisban a vírusellenes kezelés az elsődleges.
- Végül a III. fázis a szisztémás gyulladás és a citokinvihar szakasza a következményes klinikai képpel.
Többféle elnevezéssel illetik az ilyenkor jelentkező klinikai szindrómát. A COVID-19 III. szakaszát kísérő gyulladásos folyamatok hátterében a legtöbb említett citokint is termelő makrofágok aktiválódását igazolták, így született a makrofágaktivációs szindróma (MAS) elnevezés. Ismét később, amikor a patológiai folyamatokat, ezen belül a vérsejtek makrofágok általi bekebelezését is sikerült feltárni, megszületett a hemofagocitás limfohisztiocitózis (HLH) terminus.
A felnőttkori HLH vírusfertőzések, autoimmun kórképek, rosszindulatú vérképzőszervi megbetegedések, allogén csontvelő-átültetés vagy daganatok immunterápiája következtében is kialakulhat. Az utóbbi típusú kezelés során jelentkező, az IL-6 központi szerepével járó, igen hasonló tünetegyüttest citokinfelszabadulási szindrómának (CRS) nevezik. A citokinvihar következtében kialakuló HLH/MAS/CRS tehát valószínűleg nagyon hasonló klinikai jelenség.
A citokinvihar következtében kialakuló klinikai szindrómára láz, alacsony vérsejtszámok, máj- és lépmegnagyobbodás, magas ferritin, C-reaktív fehérje (CRP), D-dimer és több citokin (TNF-α, IL-2, IL-6, IL-7, G-CSF, kemokinek) magas plazmaszintje a jellemző. Ezek közül a súlyos kimenetel, az intenzív osztályos ellátás szükségessége szempontjából az együttesen emelkedett IL-6- és D-dimer-szintnek van a legmagasabb prediktív értéke. Ugyancsak e paraméterek segítenek annak megítélésében, hogy indokolt-e a citokingátló terápia. Megfelelő és időben elkezdett terápia hiányában ugyanis több szervet (tüdő, szív, máj, vese, idegrendszer, csontvelő) érintő, gyakran halálos sokszervi elégtelenség alakulhat ki.
A COVID-19 lefolyását és az egyes gyógyszerek alkalmazhatóságát az alábbi ábra szemlélteti.
Kezelési lehetőségek
Újabban az antivirális, antibiotikus és tüneti kezelés mellett egyre inkább elfogadott, hogy a gyulladás kóroki szerepe miatt a reumatológiában is használatos egyes immunmoduláló és immungátló gyógyszerek előnyösek lehetnek a COVID-19 kimenetele szempontjából.
A kortikoszteroidkezelés önmagában a vírusfertőzés miatt nem ajánlott, irodalmi adatok szerint ronthatja a túlélést.
Az autoimmun reumatológiai betegségek kezelésére is használt antimaláriás szerek, így a klorokvin és hidroxiklorokvin egyrészt gátolják a vírus sejtbe jutását, másrészt számos immunológiai folyamatba, így a citokintermelésbe is beavatkoznak.
A COVID-19-hez társuló citokinviharhoz nagyon hasonló, a vérképzőszervi daganatok immunterápiája során mellékhatásként jelentkező CRS-ben az IL-6 receptort gátló tocilizumab hazánkban is törzskönyvezve van. A COVID-19 klinikai vizsgálatában tocilizumabkezelés mellett javult a vér oxigénellátottsága, a tüdő CT-képe, csökkent a láz és a CRP, továbbá emelkedett az eredetileg alacsony fehérvérsejtszám. A szer bekerült a nemzetközi és hazai ajánlásokba (pl. COVID-19-kézikönyv). Ezek alapján a tocilizumabot megfelelő időablakban, legalább 7 nappal az első tünetek jelentkezése és lehetőleg a klinikai romlást követő 14 napon belül javasolt alkalmazni.
A tocilizumab mellett más IL-6-gátlók (sarilumab, siltuximab), az IL-1-gátló anakinra és a TNF-α-gátló adalimumab is kipróbálás alatt állnak COVID-19-ben.
Az úgynevezett célzott terápiák az immunrendszer egy adott pontján hatnak. A szintetikus célzott terápiás szerek közül a többféle citokint gátló, úgynevezett Janus-kináz (JAK) inhibitorok (baricitinib, tofacitinib) is ígéretesek. A baricitinib a citokinek mellett a vírus sejtbe jutását is gátolja.
Az egyéb kezelési lehetőségek közül a számos autoimmun betegségben használatos emberi intravénás immunglobulin, valamint a COVID-19 betegségen átesett betegek vírusellenes ellenanyagokat tartalmazó véréből tisztított, úgynevezett konvaleszcens szérumot kell még megemlíteni.
Irodalom
- A 2020. évben azonosított új koronavírus (SARS-CoV-2) okozta fertőzések (COVID-19) megelőzésének és terápiájának kézikönyve. Budapest: Emberi Erőforrások Minisztériuma, 2020.
- Fábián Á. – László I. – Juhász M. – Berhés M. – Végh T. – Koszta Gy. – Molnár Cs. – Fülesdi B.: Farmakoterápiás lehetőségek SARS-CoV-2-fertőzés/COVID–19-betegség esetén. Orvosi Hetilap, 2020, 161: 685–688.
- Szekanecz Z. – Bálint P. – Balog A. – Czirják L. – Géher P. – Kovács L. – Kumánovics G. – Nagy Gy. – Rákóczi É. – Szamosi Sz. – Szűcs G. – Constantin T.: A COVID-19 fertőzés immunológiai és reumatológiai vonatkozásai. Immunológiai Szemle, 2020, in press.
Forrás: Magyar Tudományos Akadémia, Dr. Szekanecz Zoltán és Dr. Constantin Tamás



