Koronavírus: Melyik gyógyszer lesz végül a befutó?
megjelent:
A vakcináért folyó globális verseny mellett a vírusfertőzöttek gyógyszeres kezelésének lehetőségeit is kutatások ezrei próbálják feltérképezni. Eddig egyetlen bizonyítottan hatásos szer létezik, de több tucatnyi ígéretes hatóanyagról tudunk, klinikai vizsgálatok százai vannak folyamatban.
Keserű György Miklós, a Magyar Tudományos Akadémia akadémikusa foglalta össze az eddigi eredményeket, a vírus elleni támadás lehetséges célpontjait és módszereit, valamint a magyar kutatásokat.
A kínai Vuhanból induló COVID-19-járványt okozó SARS-CoV-2 koronavírus terjedésében meghatározó szerepet játszott a cseppfertőzéssel való terjedés, a hosszú lappangási idő és a tünetmentes fertőzők folyamatos jelenléte. A járvány jelentősen megterhelte az egészségügyi ellátórendszert, és a gyors terjedés, illetve a betegség hatásainak mérséklése érdekében számos intézkedést tett szükségessé, mint az utazási korlátozások, a védőeszközök használata, a fertőtlenítés, a szociális távolságtartás, az ellátórendszer technikai felkészítése, valamint különböző terápiás protokollok kidolgozása. Már a járvány korai szakaszában többféle terápiás lehetőség merült fel: új gyógyszer kifejlesztése, amelyet kezelésre vagy megelőzésre használhatunk, vakcinafejlesztés, sőt korábban már bevált stratégiaként fertőzöttek vérplazmájának alkalmazása. Mindezek mellett lehetséges meglévő gyógyszereknek a szokásos indikáción kívüli, úgynevezett „off-label” alkalmazása, valamint meglévő gyógyszerek indikációjának kiterjesztése is. Összefoglalónkban az utóbbi két újrapozicionálási stratégia mentén feltárt, a COVID-19-járvány jelenlegi és feltételezett második hullámában rendelkezésünkre álló gyógyszeres kezelési lehetőségeket elemezzük. A lehetséges terápiákat a betegség főbb szakaszai szerint, a fertőzés által kiváltott virális választól a gazdaszervezet gyulladásos válaszáig tárgyaljuk.
Jelenleg több mint 2000 klinikai vizsgálat van folyamatban
Figyelembe véve az új gyógyszerek és vakcinák kifejlesztéséhez szükséges időt és erőforrásokat, a fokozatosan felfutó klinikai vizsgálatok jelentős része meglévő gyógyszerek COVID-19-fertőzésben való alkalmazására, azaz újrapozicionálására irányult. A gyors reagálás szüksége a klinikai vizsgálatok szabályozási környezetét is érintette, és egyaránt vonatkozott az indikáción kívüli használatra és az indikáció kiterjesztésére. Az indikáción kívüli használat Magyarországon engedélyköteles, azonban az európai és amerikai gyakorlattal összhangban az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet (OGYÉI) 2020. március 27-én ezen jelentősen könnyített. Az engedély előzetes kérelmezésének felfüggesztése lehetővé tette, hogy a koronavírus terápiájában felmerült gyógyszerkészítmények használatához az ellátóhelyeknek ne kelljen előzetes engedélyt kérniük az OGYÉI-től. A már bevezetett gyógyszerek COVID-19-fertőzésben történő használatának másik lehetséges módja az indikáció kiterjesztése, ennek azonban feltétele az új indikációban a hatékonyság és a biztonságosság tudományosan megalapozott klinikai vizsgálatokkal való igazolása. A koronavírus-járvány miatt az OGYÉI engedélyezte minden olyan fejlesztés alatt álló gyógyszer indikációjának a COVID-19-re való kiterjesztését, amelyre legalább az 1. fázisú klinikai vizsgálatot már lefolytatták, vagy ilyen vizsgálat már folyamatban van.
A folyamatban lévő klinikai vizsgálatokat a terápiás lehetőségek hatékonyságának és biztonságosságának igazolására az alkalmazott gyógyszeres kezelés szerint a betegség virális és gyulladásos fázisa alapján csoportosíthatjuk. Az antivirális terápia során figyelembe kell venni a COVID-19-fertőzés két alapvető szakaszát, az első – virális –, illetve a második – gyulladásos – szakaszt. Az antivirális készítmények elsősorban a betegség első, a vírusfertőzés által meghatározott szakaszában alkalmazhatók sikerrel, általában a középsúlyos stádiumig. A gyulladásos szakaszban az antivirális terápia önmagában legtöbbször már nem elegendő.
A virális szakaszban az újrapozicionálás lehetőségeit a vírus életciklusából kiindulva érdemes áttekinteni, lásd az alábbi ábrán:
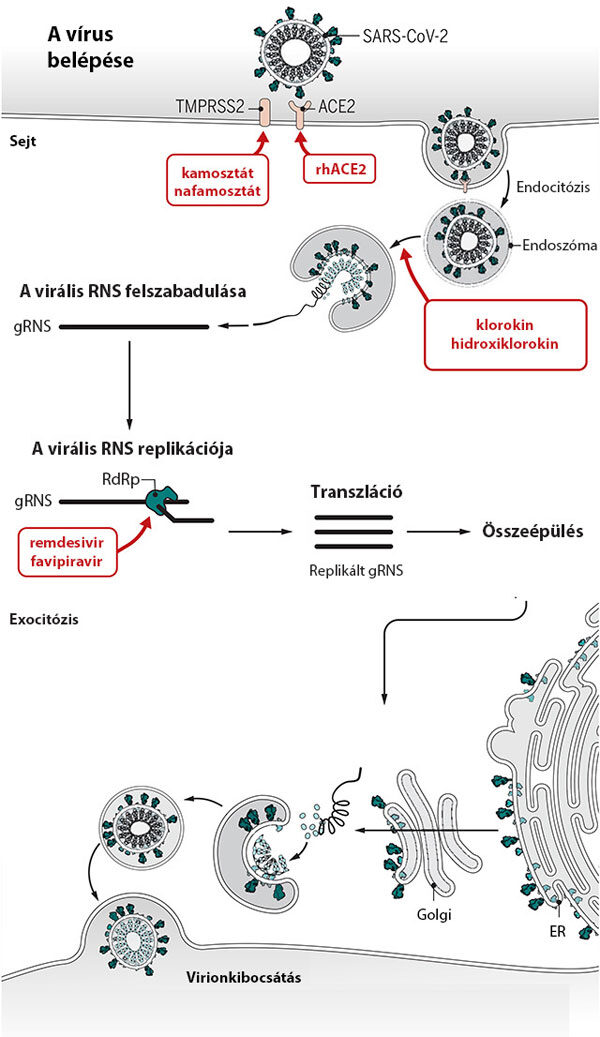
A vírus endocitózissal jut be a gazdasejtbe, amit az angiotenzin-konvertáló enzim II (ACE2) fehérje, illetve a sejtmembránban található transzmembrán-szerinproteáz 2 (TMPRSS2) fehérje gátlásával lehet megakadályozni. Amikor a vírus már bejutott a gazdasejtbe, a következő lépés a virális RNS replikációja és átírása. Ebben a folyamatban helikázok és RNS-függő RNS-polimerázok vesznek részt, amelyek szintén szóba jöhetnek lehetséges célpontként. Az életciklus következő lépése a transzláció és a megfelelő virális fehérjék létrehozása, amit leginkább proteázgátló vegyületekkel akadályozhatunk meg. Végezetül elvi lehetőség kínálkozik a virion-alkotóelemek összerendezésének, illetve az új vírusok kibocsátásának a gátlására is.
A vírus gazdaszervezetbe történő bejutását alapvetően szerinproteáz-inhibitorok segítségével kísérelték meg gátolni, amelyek közül a kamosztátot, illetve a nafamosztátot érdemes megemlíteni. A kamosztátot 1985-ben Japánban törzskönyvezték, eredetileg hasnyálmirigy-gyulladás indikációjában. COVID-19-fertőzöttek kezelésére való alkalmazása szerinproteáz-gátló hatásának köszönhetően merült fel. A hasonló hatásmechanizmusú nafamosztátot szintén Japánban törzskönyvezték 1999-ben. Jóllehet mindkét gyógyszer sikeresen gátolta a vírus szaporodását humán in vitro kísérletekben, az alacsony betegszámú és jellemzően nem klinikai vizsgálatban történt alkalmazás alapján jelenleg nem lehet egyértelmű következtetést levonni a hatékonyságukra. Jelenleg a kamosztáttal 8, a nafamosztáttal 3 klinikai vizsgálat folyik, amelyekben a hatékonyságot több esetben placebokészítménnyel, illetve hagyományos kezelési protokollal szemben vizsgálják. A kezelések terápiás hatékonyságát és biztonságosságát várhatóan e vizsgálatok végeztével lehet majd meghatározni.
A SARS-CoV-2 koronavírus gazdasejtekbe való bejutásában lényeges szerepet játszik a sejtfelszíni ACE2 fehérje is. Tekintettel arra, hogy az ACE-inhibitorokat széles körben alkalmazzák a magasvérnyomás-betegség kezelésében, e gyógyszerek lehetséges szerepe már a járvány korai szakaszában felmerült. Egyrészről feltételezték, hogy a kezelés mellékhatásaként fokozódhat az ACE2 fehérje kifejeződése, ami megnövelheti a COVID-19-fertőzés esélyét. Ugyanakkor az is felvetődött, hogy az ACE-gátlás akár kedvező hatással is lehet a betegség lefolyására. A feltételezéseket két nagy, megfigyelésalapú vizsgálatban tesztelték. Egy amerikai vizsgálatban több mint 12 000 beteg bevonásával az öt különféle, magas vérnyomás kezelésére szolgáló terápia és a pozitív, illetve negatív COVID-19-tesztek közötti összefüggést elemezték. Egy másik, olasz vizsgálatban ACE-gátló szerekkel és angiotenzinreceptor-blokkolókkal kezelt 6500 beteg COVID-19-fogékonyságát vizsgálták. Mindkét esetben arra a következtetésre jutottak, hogy a vizsgált gyógyszerek és a COVID-19-fertőzöttség között nem mutatható ki összefüggés. Az esetleges kedvező hatás kimutatására jelenleg 7 klinikai vizsgálat van folyamatban, eredményeiket még nem hozták nyilvánosságra. A nagy betegszámokon végzett elemzések ugyanakkor e gyógyszercsoport előnyös alkalmazhatóságát nem valószínűsítik.
Antitest-kombináció vagy antivirális kezelés
A vírusfertőzés megakadályozására az elmúlt időszakban olyan biológiai terápiákat is javasoltak, amelyek a vírus bejutásában szerepet játszó tüskefehérjét és/vagy az ACE2 fehérjét célozzák. Ezek közül a SARS-CoV-2 vírus tüskefehérjéjét specifikusan felismerő, kettős antitest-kombináció klinikai vizsgálata már megkezdődött az Egyesült Államokban. A randomizált, kettős vak, 3. fázisú vizsgálatba mintegy 2000 olyan tünetmentes embert vonnak be, aki egy háztartásban élt COVID-19-fertőzöttel. Ha az antitest-kombináció sikeresen gátolja a vírus bejutását, a hatékony biológiai terápia komoly vetélytársa lehet a hagyományos antivirális kezelésnek.
A virális RNS endoszómából történő kijutásában tulajdonítottak szerepet a klorokinnak, illetve a hidroxiklorokinnak. A klorokin egy 1934-ben Németországban felfedezett maláriaellenes gyógyszer, amelyet profilaxisban is használnak, míg a hidroxiklorokint 1955-ben az Egyesült Államokban regisztrálták autoimmun gyulladások, illetve reumatoid artritisz kezelésére. E vegyületek esetében többféle hatásmechanizmus is felmerült: elképzelhetőnek tartották például, hogy a virális RNS kijutásának gátlása az endo-/lizoszóma pH-jának változtatásának vagy a vegyületek közvetlen RNS-kötődésnek következménye. Ugyanakkor egyes kutatások szerint a vírusfertőzés következményeképpen kialakuló gyulladásra hatva fejtik ki hatásukat. Bár a korai in vitro és in vivo vizsgálatok reménykeltőek voltak, a klinikai vizsgálatok e gyógyszerek hatékonyságát COVID-19-fertőzésben nem igazolták. A klorokin és a hidroxiklorokin esete ezért jó példa arra, hogy az újrapozicionálás sikerességét egyedül tudományos igényű klinikai vizsgálatokban lehet bizonyítani.
Az antivirális szerek egyik legfontosabb támadáspontja az RNS-függő RNS-polimeráz, amelyre korábban több specifikus gátlószert is kifejlesztettek. Tekintettel arra, hogy a COVID-19-fertőzést okozó SARS-CoV-2 az RNS-vírusok családjába tartozik, a COVID-19-járványban leginkább ezeket a gyógyszereket, elsősorban a remdesivirt és a favipiravirt próbálták ki. A remdesivirt 2009-ben az Egyesült Államokban fejlesztették ki, alapvetően hepatitis C vírus, Marburg-vírus, illetve Ebola-vírus okozta fertőzések ellen. A remdesivirrel számos klinikai vizsgálatot végeztek COVID-19-fertőzésben, illetve jelenleg is több ilyen vizsgálat van folyamatban. Az első randomizált, kettős vak, placebokontrollált vizsgálatot Kínából jelentették, amelynek során 158 súlyos beteg kapott remdesivirt, míg a vizsgálat placebokarjában 78 beteg volt. Jóllehet a vizsgálatot a betegbevonás nehézségei miatt a tervezett betegszám elérése előtt leállították, a klinikai tünetek javulásához szükséges idő (21, illetve 23 nap), valamint a mortalitás (14%, illetve 13%) a két csoportban nem különbözött szignifikánsan. Az amerikai gyártó által végzett, randomizált, nyílt, 3. fázisú vizsgálatban (SIMPLE-Severe) 200 súlyos beteget 5 napig, míg 197 szintén súlyos beteget 10 napig kezeltek remdesivirrel. A klinikai tünetek mindkét csoportban javultak, az első csoport betegei közül 65%, a második csoport betegei közül pedig 54% reagált kedvezően a gyógyszeres kezelésre. Egy szintén amerikai vizsgálatban középsúlyos COVID-19-fertőzötteket kezeltek remdesivirrel. 191 beteget 5 napig, 194 beteget 10 napig kezeltek, míg 200 beteg hagyományos ellátást kapott. Az egyes csoportokban a klinikai tünetek a betegek 70, 65, illetve 61%-a esetében javult, azonban a hagyományos kezeléssel szemben statisztikailag szignifikáns különbséget nem sikerült kimutatni.
Több klinikai vizsgálat készült
Az első tényleges sikert csak ezt követően egy nagyobb elemszámú, 1059 beteggel végzett, újabb, randomizált, kettős vak, placebokontrollált, 3. fázisú vizsgálat hozta, amelyben 539 remdesivirrel kezelt beteg esetében a klinikai tünetek 11 nap alatt javultak, szemben a placebokarban tapasztalt 15 nappal. A remdesivirkezelés a mortalitást is szignifikánsan csökkentette (7,1% vs. 11,9%). A vizsgálat eredménye alapján az amerikai Élelmiszer- és Gyógyszerfelügyelet (FDA) engedélyezte a remdesivir alkalmazását COVID-19-fertőzésben, amit hamarosan az európai (EMA) és a japán hatóság (PMDA) is követett. Jelenleg a remdesivir az egyetlen olyan vírusellenes terápia, amelynek hatékonyságát és biztonságosságát legalább egy tudományosan megalapozott klinikai vizsgálatban sikerült igazolni. A gyógyszerrel természetesen további vizsgálatok folynak (jelenleg 34 ilyen vizsgálatot tartanak számon), eredményeik pedig döntőek lehetnek a remdesivir alkalmazhatóságának és terápiás értékének megítélésében.
A SARS-CoV-2 vírus RNS-függő RNS-polimerázának gátlására alkalmas másik antivirális gyógyszer a favipiravir, amelyet 2014-ben, az influenza A és B típusának kezelésére vezettek be Japánban. A favipiravir egy széles spektrumú antivirális gyógyszer, amely számos RNS-vírus ellen alkalmazható sikerrel. Idetartozik a sárgalázvírus, a dengue-vírus, a nyugat-nílusi vírus, a korábbi SARS- és MERS-vírus, az influenzavírusok, a Lassa-lázat okozó vírus, a különböző hantavírusok, az Ebola-, illetve a Sudan-vírusok is. Favipiravirral eddig két befejezett kínai klinikai vizsgálat történt. Az egyik esetben multicentrumos, randomizált klinikai vizsgálat során kontrollként egy másik antivirális készítményt, arbidolt használtak. 116 beteget kezeltek favipiravirral, míg a kontrollcsoportban 120 beteg volt.
A vizsgálatok a betegség lefolyásának megfelelően a virális első szakaszra koncentráltak, súlyos esetek bevonására nem került sor. Mivel a vírusellenes szerek többségére (pl. influenza-, hepatis C-ellenes szerek) jellemző lehet a magzatkárosító mellékhatás, a vizsgálatokban és a favipiravir további alkalmazásaiban a terhesség kizáró ok. Fontos azonban megjegyezni, hogy a fogamzóképes nők nem is tartoznak a COVID-19-fertőzés első számú kockázati csoportjai közé. Végpontként a klinikai felépülést, valamint a láz és köhögés változását határozták meg. A vizsgálat eredményeképpen azt tapasztalták, hogy a favipiravirral kezelt csoportban a betegek mintegy 70%-a gyorsabb klinikai felépülést mutatott, és a tüneteik is jelentősen enyhültek, szemben a kontrollcsoporttal, amelyben kb. 55%-os volt a klinikai javulás. A favipiravirkezelés szignifikánsan csökkentette a láz és a köhögés idejét, lényeges mellékhatásokat nem okozott, a gasztrointesztinális tünetek mellett szérumhúgysav-emelkedést figyeltek meg, ami a betegek mintegy 13%-át érintette.
A másik klinikai vizsgálat egy nehezebben értékelhető, nem randomizált, egycentrumos vizsgálat volt lényegesen kevesebb beteg bevonásával. Ebben a favipiravirral kezelt karba 45 beteget, a kontrollkarba 35 beteget vontak be, akiket lopinavirral és ritonavirral kezeltek. A vizsgálat elsődleges végpontja a vírusterhelés csökkenése volt, emellett egy szigorúan értékelt CT-vizsgálattal figyelték a tüdőgyulladás előrehaladását. Azt tapasztalták, hogy a vírus kiürüléséig eltelt napok száma a favipiravirral kezelt csoportban 4 nap, míg a kontrollcsoportban átlagosan 11 nap volt. A favipiravirkezelés hatására a betegek 92%-ának szignifikáns javulást mutatott a mellkas-CT-je, míg a kontrollcsoportban a javulás 62%-nál jelentkezett. Hasonlóan az első vizsgálathoz itt sem tapasztaltak lényeges mellékhatásokat. A húgysavszint emelkedése ebben az esetben is megfigyelhető volt a betegek mintegy 11%-ánál.
Az eddig nyilvánosságra hozott adatok ugyan biztatóak, de a favipiravir hatékonyságát és biztonságosságát a COVID-19-fertőzésben tudományos igényű klinikai vizsgálattal eddig még nem erősítették meg. Az eddigi vizsgálatok alapvetően vészhelyzeti forgatókönyv alapján, „off-label” alkalmazásra épülő vizsgálatok voltak, ráadásul az egyik esetben a randomizálás is elmaradt. Ezek alapján joggal merül fel, hogy a favipiravir hatékonyságát szigorúan kontrollált klinikai vizsgálatban kell bizonyítani. A COVID-19-járvány hazai terjedésével kutatócsoportunk a favipiravir antivirális készítmény fejlesztésével és vizsgálatával kezdett foglalkozni. Ennek érdekében indult meg az Innovációs és Technológiai Minisztérium támogatásával a magyar favipiravirfejlesztés, amelynek alapvetően három célja volt. Az első cél a független hazai gyártás biztosítása a magyar COVID-19-betegek számára, a második a már említett tudományos igényű klinikai vizsgálat, amellyel a hatékonyságot és a biztonságosságot tudjuk igazolni COVID-19-fertőzésben. Ez egyben megalapozhatja a favipiravir újrapozicionálását influenzaindikációból COVID-19-fertőzés kezelésére.
A hatóanyag és a gyógyszerkészítmény fejlesztését a Természettudományi Kutatóközpont által vezetett konzorcium (TTK, Első Vegyi Indusztria Zrt., Richter Gedeon Nyrt., Meditop Kft.) valósítja meg. A klinikai vizsgálatok szervezését és lebonyolítását a HECRIN által szervezett konzorcium végzi. A klinikai vizsgálóhelyek magukban foglalják a négy orvostudományi egyetem klinikai centrumait, valamint a Dél-pesti Centrumkórház Országos Hematológiai és Infektológiai Intézetét, illetve az Országos Korányi Pulmonológiai Intézetet. A két tervezett vizsgálat közül az első egy multicentrumos, placebokontrollált, adaptív 2. fázisú / 3. fázisú vizsgálat az általunk fejlesztett magyar favipiravirkészítménnyel. A másik egy nyílt, 3. fázisú referenciavizsgálat a japán Avigan készítménnyel, amelyet a japán kormány biztosított számunkra. A projektek egy harmadik lehetséges célja, hogy amennyiben a favipiravir hatékonysága és biztonságossága a COVID-19-fertőzésben igazolódik, akkor a gyártás felfuttatásával a favipiravir exportcikk lehessen Magyarország számára.
Az RNS-vírusok szaporodását specifikusan gátolni képes gyógyszerek mellett a COVID-19-fertőzöttek kezelésére további antivirális gyógyszerek is felmerültek. Ezek közé tartoznak az HIV-fertőzés, illetve az influenza kezelésére alkalmazott más gyógyszerek. A HIV-gyógyszerek közül legkorábban a lopinavirral, a ritonavirral, illetve a darunavirral kezdődtek vizsgálatok, azonban ezeknek a gyógyszereknek a hatékonyságát COVID-19-fertőzésben eddig nem sikerült bizonyítani. Hasonlóképpen hatástalannak mutatkoztak a korábban influenza esetében sikeres neuramidázgátlók (oszeltamivir, zanamivir), valamint az umifenovir is.
A vírusfertőzés következményeként kialakuló gyulladás lehetséges patomechanizmusát követve a súlyos és kritikus állapotú COVID-19-betegek kezelésére az általános gyulladáscsökkentő terápiák mellett az érintett jelátviteli útvonalak gátlása is szóba jöhet.
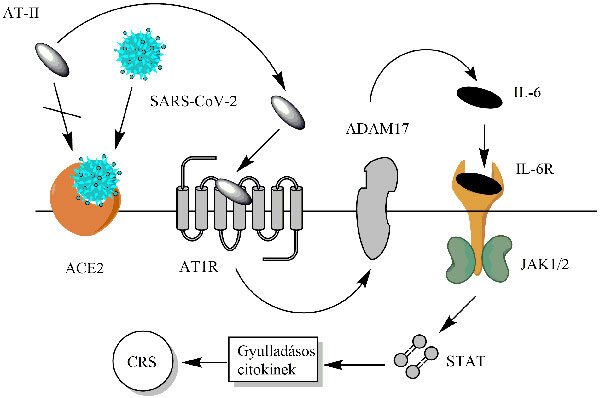
A vírus gazdaszervezetbe való bejutásában érintett ACE2 enzim az egészséges szervezetben lebontja az angiotenzin II peptidet (AT-II). A SARS-CoV-2 koronavírus azonban, miközben ezt az enzimet használja a bejutásra, egyben megakadályozza az AT-II lebontását, így a jelen lévő AT-II aktiválja az angiotenzin-1 receptort. Ez egyrészről közvetlenül serkenti a JAK/STAT jelátviteli útvonalat, másrészről pedig az ADAM17 aktiválásán keresztül fokozza az interleukin-6 (IL-6) gyulladásos faktor mennyiségét. A két folyamat eredményeképpen létrejövő STAT-aktiválódás azután nagy mennyiségű gyulladásos faktor képződését indítja el, ami a fokozódó IL-6-szintekkel együtt végül a citokinfelszabadulás-szindróma (CRS) kialakulásához vezet.
Az anticitokin-kezelések
A vírusfertőzés következtében fellépő általános gyulladás kezelésére elsősorban az immunmodulációt kiváltó, citokinellenes készítmények, valamint gyulladásgátló kortikoszteroidok jönnek szóba. Az anticitokin-kezelések során főként interleukin-1-et (IL-1) és -6-ot (IL-6) gátló már bevezetett humánantitestekkel folynak vizsgálatok. Az anti-IL-1-hatású anakinra egy rekombináns technológiával előállított antitest, amelynek esetleges kedvező hatása a gyulladásos fázisba jutott COVID-19-betegekben általában megnövekedett IL-1-szintekkel hozható összefüggésbe. Erre a megfigyelésre alapozva merült fel az anakinra alkalmazhatósága CRS-ben. Bár az anakinrakezelés hatékonyságát eddig prospektív klinikai vizsgálatokban nem sikerült megerősíteni, több megfigyelésen alapuló, nyílt vizsgálatban is biztató eredményeket tapasztaltak. Alacsony elemszámú kínai, francia és olasz vizsgálatok egybehangzóan megerősítették, hogy az anakinrakezelés hatására a gyulladásos faktorok mennyisége számottevően csökkent. A kezelések hatékonyságának tudományosan meggyőző bizonyítására jelenleg 23 klinikai vizsgálat van folyamatban, a gyógyszer terápiás értékét csak az ezekből származó eredmények alapján lehet majd megítélni. Az anticitokin-kezelés COVID-19-fertőzésben felmerült másik lehetősége az IL-6-receptor gátlása, amely az IL-6 gyulladásos citokin kötődésének megakadályozásával járulhat hozzá a CRS-t kísérő súlyos, életveszélyes tünetek visszaszorításához.
Kezelési lehetőségként rekombináns humanizált antitestek, a monoklonális IL-6-specifikus tocilizumab és sarilumab merült fel. A tocilizumabkezelés hatását eddig többnyire megfigyelésen alapuló és nyílt klinikai vizsgálatokban mérték fel. Ezekben az esetekben főként súlyos, illetve kritikus állapotú COVID-19-betegeket kezeltek, akiknél a kezelés hatására néhány nap után a láz gyors csökkenését figyelték meg, miközben kevésbé szorultak kiegészítő oxigénellátásra. A tocilizumabkezelést Magyarországon is sikeresen alkalmazták a Dél-pesti Centrumkórházban súlyos állapotú betegek kezelésére. A kedvező előzetes adatok alapján a kezelés számos országban vált a kezelési protokoll részévé. A gyógyszer hatékonyságának tudományos igazolására jelenleg 64 vizsgálat van folyamatban. A tocilizumabkezelések biztató eredményei alapján az Egyesült Államokban egy nagy elemszámú, randomizált, kettős vak elrendezésű, placebokontrollált adaptív 2./3. fázisú klinikai vizsgálat indult a sarilumab hatékonyságának vizsgálatára súlyos és kritikus állapotú COVID-19-betegeken.
A kezelés hatására a gyulladásos faktorok mennyiségének számottevő csökkenését tapasztalták, míg az előzetes adatok alapján a kritikus állapotú betegek esetében a mortalitás 36%-ról 23%-ra csökkent. A kezelés terápiás előnyeinek további vizsgálata érdekében jelenleg 16 klinikai vizsgálat zajlik, amelyek a tocilizumabvizsgálatok eredményeivel együtt alátámaszthatják az anti-IL-6-kezelés hatékonyságát súlyos és kritikus állapotú betegek esetében.
A gyulladásos tünetek uralkodóvá válása szinte önkéntelenül felveti a szteroid gyulladáscsökkentők alkalmazásának lehetőségét, amelyek közül a COVID-19-betegek terápiájában leginkább a metilprednizolon és a dexametazon került előtérbe. A kortikoszteroidok immunszupresszáns hatásuk miatt alkalmasak lehetnek a CRS terápiájában, illetve segíthetnek a tüdőgyulladás következtében kialakuló légúti és szisztémás gyulladás visszaszorításában, valamint az esetleges szepszis következtében fellépő kóros immunválasz normalizálásában. Ugyanakkor fontos megjegyezni, hogy a kortikoszteroidok alkalmazása enyhe és középsúlyos COVID-19-fertőzöttek kezelésében kifejezetten ellenjavallt, ugyanis az immunválasz gátlásával ronthatják a vírus elleni védekezést, és növelhetik a vírusterhelést. Ezért a metilprednizolont és a dexametazont többnyire súlyos és kritikus állapotú betegek ellátásában használják az ebben a fázisban fellépő akut légzésidistressz-szindróma (acute respiratory distress syndrome, ARDS) kezelésére. A korai kortikoszteroid-kezelés egy retrospektív amerikai klinikai vizsgálat alapján is ellenjavalltnak látszik.
A dexametazon
A dexametazonnal kapcsolatban néhány kisebb, döntően megfigyelésen alapuló vizsgálat mellett egy nagyobb angol klinikai vizsgálat előzetes eredményei ismertek. A randomizált, kontrollált, nyílt klinikai vizsgálatba több mint 6000 beteget vontak be. A jelenleg rendelkezésre álló adatok alapján a súlyos betegek esetében a kezelés csökkentette a mortalitást, és ez a hatás különösen szembetűnő volt a géppel lélegeztetett betegeknél. A dexametazon emellett számottevően csökkentette az intenzív terápiás, valamint az általános kórházi ellátás időtartamát. Ebben az esetben is fontos azonban hangsúlyozni, hogy a megalapozott terápiás ajánlások megfogalmazásához a teljes adatkészlet, valamint a jelenleg is zajló 23 további klinikai vizsgálat eredményeinek részletes feldolgozására van szükség. A metilprednizolonnal eddig kevesebb tapasztalat gyűlt össze, ezek is javarészt vészhelyzeti forgatókönyv alapján folytatott, megfigyelésen alapuló vizsgálatokból származnak. A biztató korai eredmények megerősítéséhez meg kell várni a gyógyszerrel jelenleg folyó 32 klinikai vizsgálat eredményeinek kiértékelését.
A gyulladásban szerepet játszó interleukin-receptorokat érintő jelátviteli terápia mellett, feltételezések szerint, a JAK/STAT jelátviteli útvonal gátlása is eredményes lehet a betegség virális és gyulladásos szakaszában. Ezek a gyógyszerek egyfelől az endocitózis gátlásával megakadályozhatják a vírus bejutását a gazdaszervezetbe, sőt akár a virion összeszerelését is blokkolhatják. Másfelől viszont – eredeti rendeltetésüknek megfelelően – a JAK-inhibitorok gátolják egyes gyulladásos faktorok felszabadulását, és ezáltal hozzájárulhatnak a CRS kialakulásának megakadályozásához. Ugyanakkor ezek között a faktorok között olyanok is lehetnek – például az interferon –, amelyek éppen a kontrollálatlan gyulladás ellenében hatnak.
A forgalomban lévő JAK-inhibitorok közül eddig a baricitinibet és a ruxolitinibet alkalmazták COVID-19-betegek kezelésére. Baricitinibbel kis elemszámú, nyílt vizsgálatokban többnyire súlyos fertőzötteket kezeltek, akik a kezelést jól tolerálták, hatására jelentősen javult a légzésfunkciójuk, többségük elhagyhatta az intenzív terápiás részleget. A ruxolitinib esetében szintén kis elemszámú, de prospektív, randomizált, placebokontrollált vizsgálatban két hét alatt szignifikáns javulást tapasztaltak a mellkas-CT alapján, ugyanakkor a betegek továbbra is kórházi ellátásra szorultak. Fontos megjegyezni, hogy ebben a vizsgálatban, mint a vészhelyzeti forgatókönyv alapján végzett szinte valamennyi esetben, a betegek más gyógyszereket, így szteroid gyulladáscsökkentő és antivirális kezelést is kaptak, ezért a JAK-gátlás hatékonyságát önmagában nehéz megítélni. E célból jelenleg a baricitinibbel 12, a ruxolitinibbel 20 klinikai vizsgálat folyik.
A betegség kezelési lehetőségei változatlanul korlátozottak
Alig több mint fél évvel a COVID-19-járvány világméretűvé szélesedését követően sajnos azt kell megállapítanunk, hogy a betegség kezelési lehetőségei változatlanul korlátozottak. A széles nemzetközi összefogás és a jelentős kutatási és fejlesztési ráfordítások ellenére a legtöbb lehetséges terápia esetében csak előzetes klinikai eredmények állnak rendelkezésre. Ráadásul ezek az adatok sokszor ellentmondásosak, illetve nem teszik lehetővé, hogy egyértelmű következtetést vonjunk le belőlük a kezelések hatékonyságát illetően. A gyógyszerkutatás és -fejlesztés szigorúan szabályozott folyamatainak ismeretében ezen nem lepődhetünk meg. Mivel egy új gyógyszer kifejlesztése nemcsak költséges, de időben is hosszú, akár évtizedekig tartó folyamat, a COVID-19-járvány esetében felmerülő azonnali orvosi igény csak már gyógyszerként alkalmazott molekulák klinikai tesztelésére adott lehetőséget.
A vizsgálatok döntő többségét azonban a kialakult járványhelyzetben vészhelyzeti forgatókönyv alapján kellett megvalósítani. Ez azt jelentette, hogy a kezelések nem tudták követni a hatékonyság és biztonságosság tudományos bizonyításához szükséges nemzetközi protokollokat. A vizsgálatok többnyire kis elemszámú, nyílt, sokszor nem randomizált és vak, placebokart nem tartalmazó kezelésekké alakultak, amelyek elsődleges célja értelemszerűen a betegek életének megmentése volt. A nemzetközileg elfogadott, tudományos szempontoknak megfelelő szabályok alapján indított klinikai vizsgálatok döntő többsége csak késve tudott elindulni. Ennek okai között ott van az általában könnyített szabályozási környezet továbbra is szükséges és lényeges követelményeinek teljesítése, a járványügyi intézkedések közepette túlteljesítő ellátórendszer súlyos leterheltsége és az a tény is, hogy a COVID-19-járvány első hullámának csillapodásával a betegbevonások is akadoztak. Mindezek ellenére elmondható, hogy a második hullámban a gyógyszeres kezelési lehetőségek jelentősen jobb feltételeket teremtenek a fertőzöttek számára.
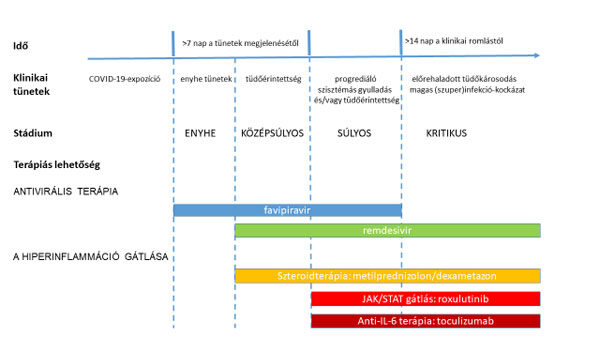
Az antivirális kezelésben a remdesivir- és a favipiravirkezelés hozhat megoldást, míg a kialakuló gyulladás esetében a jelátviteli terápia és a szteroid gyulladáscsökkentők alkalmazása segíthet a súlyos fertőzöttek kezelésében. A második hullámban a növekvő fertőzésszámok ugyanakkor a jelenleg futó klinikai vizsgálatok gyors befejezésével hozzájárulhatnak a tudományosan igazolt hatékonyságú, új terápiák megjelenéséhez.
Bár összefoglalónkban a jelenleg rendelkezésre álló gyógyszeres terápiák áttekintésére törekedtünk, fontos megemlíteni, hogy a világ tudományos közössége, gyógyszeripari szereplőkkel együttműködve, olyan kutatási programokon is dolgozik, amelyek új vírusellenes kezelési lehetőségeket céloznak. Ezek a részben hagyományos gyógyszeres, részben biológiai terápiák (terápiás fehérjék és antitestek) kutatását szolgáló projektek a SARS-CoV-2 vírus és más koronavírusok ellen jelenthetnek hatékony segítséget, azonban jellemzően még több kutatási és fejlesztési fázist kell sikeresen teljesíteniük, míg idővel megjelenhetnek a terápiás gyakorlatban.
Ajánlott cikkek a COVID-19-járványról |




